- تاریخ انتشار: 21 آذر 1400
در صنایع دارویی، تجهیزات پزشکی و صنایع بالینی که دستگاه هایی با عملکرد بالا مورد نیاز است، حتی ناسازگاری های کوچک می تواند بدون وجود پروتکل های صلاحیت و اعتبارسنجی مناسب، به مشکلات جدی تبدیل شود.
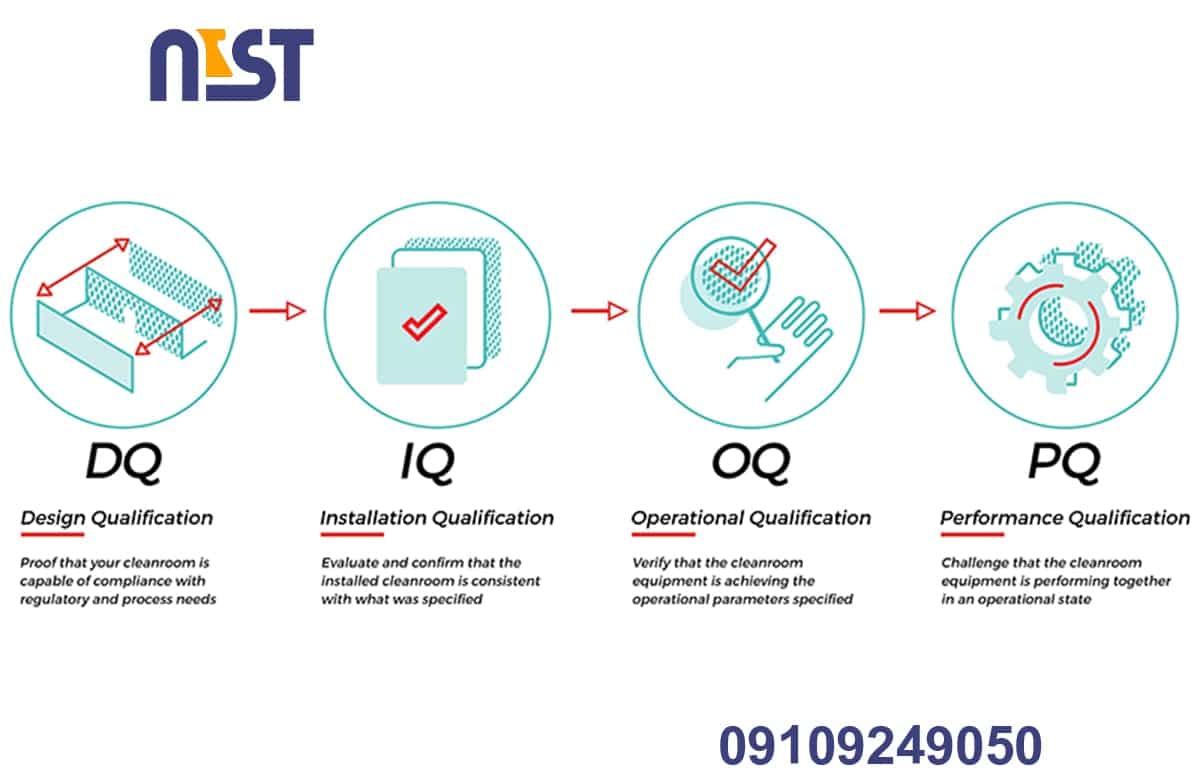
به عنوان یکی از مؤلفههای تضمین کیفیت، اعتبار سنجی تجهیزات برای تولید محصولات با کیفیت و سازگار کاملاً حیاتی است. یکی از مجموعههای کلیدی پروتکلها در اعتبار سنجی تجهیزات، صلاحیت نصب (IQ)، صلاحیت عملیاتی (OQ) ، صلاحیت عملکرد (PQ) و صلاحیت طراحی (DQ) است.
این پروتکلهای اعتبارسنجی روشی برای ایجاد شواهد مستندی هستند که درجه بالایی از اطمینان را نشان میدهند که باعث میشود فرآیند تولید به طور مداوم، محصولی با کیفیت بالا و قابل تکرار به بازار ارائه دهد.
این راهنما توضیحی واضح و ساده از اینکه این مفاهیم چیست، چرا اهمیت دارند، چه چیزی باعث موفقیت آنها میشود و مدلی برای ارتباط با متخصصانی که میتوانند این نوع پروژهها را برنامهریزی و اجرا کنند، ارائه میدهد.
فهرست مطالب
گواهینامه IQ/OQ/PQ/DQ چیست؟
پروتکلهای IQ/OQ/PQ/DQ روشهایی برای نشان دادن این موضوع هستند که تجهیزات مورد استفاده یا نصب، درجه بالایی از تضمین کیفیت را ارائه میدهند، به طوری که فرآیندهای تولید به طور مداوم محصولاتی را تولید میکنند که الزامات کیفیت را برآورده میکنند.
از آنجایی که این مفاهیم پیچیده هستند، بهتر است آنها را یک به یک بررسی کنیم.
گواهینامه نصب (IQ)
تجهیزات تازه نصب شده یا اصلاح شده ابتدا باید اعتبار سنجی شوند تا مشخص شود که آیا قادر به ارائه نتایج مورد نظر از طریق صلاحیت طراحی (DQ) هستند یا خیر. پروتکلی که به عنوان تأیید مستند توانایی یک طرح پیشنهادی برای برآورده کردن الزاماتی که باید انجام دهد را ارائه میدهد، IQ نام دارد.
اما نحوه عملکرد یک واحد سخت افزار یا نرم افزار خاص در سناریوهای دنیای واقعی به روش نصب بستگی دارد. صلاحیت نصب (IQ) تأیید میکند که ابزار یا واحدی از تجهیزات واجد شرایط (و همچنین زیرسیستمهای آن و هر سیستم فرعی) بر اساس مشخصات سازنده یا چک لیست نصب؛ نصب و پیکربندی شده است.
به عنوان مثال، یک ابزار فیزیکی ممکن است به مقدار مشخصی از فضای کف، شرایط عملیاتی خاص، و اطمینان از اینکه هیچ آسیبی به واحد وارد نمیشود، نیاز داشته باشد. برای نرمافزار، IQ معمولاً شامل تأیید درستی ساختار پوشهها و اطمینان از برآورده شدن حداقل الزامات سیستم است (اما به هیچ وجه محدود به آن نیست).
صرف نظر از اینکه این یک واحد فیزیکی یا نرم افزاری در حال آزمایش است، تعریف FDA از IQ بیانیه مفیدی از هدف کلی ارائه می دهد: مستندسازی این که “سیستم دارای شرایط پیش نیاز لازم برای عملکرد مطابق انتظار است.”
پس از گواهی IQ اولیه، صلاحیت مجدد باید پس از هر گونه تعمیر و نگهداری عمده یا زمانی که تجهیزات اصلاح می شود انجام شود. صلاحیت مجدد نیز باید به عنوان بخشی از فرآیندهای معمول تضمین کیفیت انجام شود.
چه چیزی باعث موفقیت اعتبار سنجی IQ می شود؟
IQ موفقیت آمیز معمولاً با میزان پیروی فرآیند نصب از دستورالعمل های سازنده و برآورده شدن الزامات آنها اندازه گیری می شود.
این اغلب شامل (اما محدود به) حوزه های زیر است:
- محل نصب و فضای لازم
- اسناد و مدارک مربوط به تمام ابزار دقیق کنترل شده توسط کامپیوتر
- جمع آوری تمام دستورالعمل ها و گواهینامه ها
- بازکردن صحیح بسته بندی و بازرسی متقابل ابزار
- بررسی ابزار و اجزای سازنده از نظر آسیب
- اطمینان از منبع تغذیه صحیح
- نصب وسایل جانبی
- مستندسازی نسخه های سیستم عامل و شماره سریال
- شرایط محیطی و عملیاتی
- بررسی نصب و دسترسی سیستم نرم افزار
- ثبت تاریخ کالیبراسیون و اعتبار سنجی ابزارهای مورد استفاده برای IQ
- بررسی اتصالات و ارتباط با واحدهای جانبی
گواهینامه عملیاتی (OQ)
صلاحیت عملیاتی (OQ) پس از رعایت هر پروتکل IQ انجام می شود. هدف OQ تعیین این است که عملکرد تجهیزات با مشخصات مورد نیاز کاربر در محدوده عملیاتی مشخص شده توسط سازنده مطابقت دارد. در عمل، این به معنای شناسایی و بازرسی ویژگیهای تجهیزاتی است که میتواند بر کیفیت محصول نهایی تأثیر بگذارد.
در طول OQ، تمام موارد موجود در طرح تست، تست شده و عملکرد آنها به طور کامل مستند شده است. از آنجایی که این یک پیش نیاز برای پذیرش تجهیزات و تسهیلات است، تنها پس از اجرای IQ می توان آن را انجام داد.
به طور کلی، OQ به عنوان بررسی دقیق راهاندازی سختافزار یا نرمافزار، بهرهبرداری، نگهداری، تمیز کردن و رویههای ایمنی (در صورت وجود و مکانهای کاربردی) عمل میکند. هر واحد سخت افزار و نرم افزار باید نشان داده شود که در محدوده های مشخص شده کار می کند.
چه چیزی باعث موفقیت OQ می شود؟
همانطور که در بالا توضیح دادیم، موارد عمل OQ عبارتند از شناسایی و بازرسی اجزای تجهیزاتی که بر کیفیت محصول تأثیر میگذارند و اطمینان حاصل میکنند که آنها در محدودههای خاص عمل میکنند.
اینها اغلب شامل (اما باز هم به هیچ وجه محدود به) موارد زیر هستند:
- کنترل دما و تغییرات
- سرعت موتور و فلپ هوا
- سیستم های حفاظت از دما
- کارتخوان ها و سیستم های دسترسی
- کنترل کننده های فشار و خلاء
- توزیع دما
- واحدهای نمایشگر و LED های سیگنالینگ
- کنترل CO2
- اندازه گیری و کنترل رطوبت
- فن و کنترل کننده سرعت فن
گواهینامه عملکرد (PQ)
مرحله نهایی تجهیزات واجد شرایط PQ است. در این مرحله، تیم صلاحیت و اعتبارسنجی تأیید می کند و مستند می کند که الزامات کاربر تأیید شده است. این الزامات کاربر باید شامل محدوده عملیاتی عادی مورد نیاز باشد (همانطور که توسط IQ تعریف و امضا شده و در DQ تأیید شده است). هنگامی که تجهیزات را واجد شرایط ساختید، می توانید هر فرآیند مورد نیاز برای هر محصول را توسعه دهید. سپس، هنگامی که هر فرآیند به طور کامل توسعه یافت، می توان آن را تأیید کرد.
به جای اینکه اجزا و ابزارها را یک به یک آزمایش کند، PQ همه آنها را به عنوان یک فرآیند جزئی یا کلی آزمایش می کند.
با این حال، قبل از شروع مرحله مقدماتی، تیم باید یک برنامه آزمایشی دقیق بر اساس شرح فرآیند ایجاد کند. توجه به این نکته مهم است که کیفیت صلاحیت تا حد زیادی به کیفیت طرح آزمون بستگی دارد. این یکی از حوزههایی است که میتوان (و اغلب باید) متخصص شخص ثالث را برای اطمینان از دقت و صحت وارد کرد.
پروتکل Process Performance Qualification (PPQ) یک جزء اساسی از اعتبار سنجی و صلاحیت فرآیند است. هدف آن تضمین کیفیت مداوم محصول با مستندسازی عملکرد در یک دوره زمانی برای فرآیندهای خاص است.
معیارهای FDA برای پروتکل های PQ و PPQ
سازمان غذا و داروی آمریکا در راهنمای خود، «تأیید اعتبار فرآیند: اصول و روشهای عمومی»، مرحله PQ را به دو عنصر خود به طور رسمی تعریف میکند:
- طراحی تاسیسات و صلاحیت تجهیزات و تاسیسات
- صلاحیت عملکرد فرآیند (PPQ)
در مرحله دوم، FDA در دستورالعمل خود بیان میکند که «روشهای مطابق با CGMP باید رعایت شود» و اضافه میکند که «تکمیل موفقیتآمیز مرحله 2 قبل از توزیع تجاری ضروری است».
دستورالعمل FDA شامل عناصر زیر به عنوان بخشی از پروتکلهای PQ و PPQ توصیه میکند:
- شرایط ساخت مانند محدودیت های تجهیزات، پارامترهای عملیاتی و ورودی های جزء
- فهرست کاملی از داده هایی که باید در طول آزمایش ها، کالیبراسیون و اعتبارسنجی ثبت یا تجزیه و تحلیل شوند
- تست هایی برای اطمینان از کیفیت ثابت در طول تولید
- یک طرح نمونهبرداری که جزئیات روشهای نمونهبرداری مورد استفاده در طول و بین دستههای تولید را نشان میدهد
- روش تجزیه و تحلیل برای اتخاذ داده ها، تصمیمات علمی و ریسک محور بر اساس داده های آماری
- تعاریف محدودیت های تغییرپذیری و طرح های احتمالی برای رسیدگی به عدم انطباق
- تایید پروتکل PPQ توسط بخش های مربوطه – یعنی واحد کیفیت.




دیدگاه شما